




Recherche médicale en cours  Essais cliniques – Nouveaux concepts Pr Olivier SITBON La Recherche Fondamentale (« Bench ») s’intéresse aux mécanismes physiopathologiques impliqués dans certaines maladies. La Recherche Clinique (« Bedside ») a pour but d’étudier l’effet des molécules/médicaments sur des sujets sains puis sur des malades. La Recherche Translationnelle (« Transfer ») a pour but de développer des molécules à partir des connaissances fondamentales puis de les tester chez l’homme. I - La recherche clinique (dans l’HTAP) 1. Les différentes phases d’un essai clinique • Essai de phase I : essais chez des sujets volontaires sains, essentiellement pour étudier la tolérance d’une molécule • Essai de phase II : premiers essais chez un petit nombre de malades afin de rechercher la dose ayant le meilleur rapport efficacité / tolérance • Essai de phase III : il s’agit des essais à plus grande échelle, réalisés chez des malades, afin de prouver l’efficacité d’une molécule, en la comparant avec un placebo ou plus rarement un autre médicament (très difficile dans l’HTAP car il les essais comparatifs d’un médicament par rapport à un autre nécessitent un nombre très important de malades). Les résultats des essais de phase III servent de base à l’enregistrement des médicaments par les autorités de santé. • Essai de phase IV : essais réalisés après enregistrement, voire après commercialisation, d’un médicament, ayant pour but d’évaluer la tolérance à long terme d’un médicament sur de nombreux malades, et en particulier rechercher des effets indésirables rares qui n’auraient pas été observés dans les phases précédentes. 2. Les termes utilisés dans les essais cliniques Essai contrôlé : une molécule est testée par rapport à un placebo ou un traitement de référence Essai « randomisés » : il s’agit d’un essai dans lequel un tirage au sort informatisé est effectué pour déterminer qui reçoit quel médicament. Le médecin ne choisit jamais qui va recevoir quoi. La plupart des essais contrôlés sont « randomisés ». Essai en double-aveugle : cela signifie que ni le malade, ni le médecin ne sait quel traitement est administré (médicament à l’étude ou son comparateur). Les essais de phase III sont habituellement des essais contrôlés, randomisés, en double aveugle, contre placebo. Essai en ouvert : le médecin et le malade savent quel traitement est administré. Les essais de phase IV sont en général des essais en ouvert. Essai observationnel : il s’agit en général d’un essai en ouvert qui étudie de façon rétrospective l’effet de la molécule testée sur une cohorte de malades Essai de supériorité : On cherche à montrer que la molécule testée est plus efficace qu’un placebo. Dans l’HTAP, les essais de phase III sont en général des essais de supériorité. Essais de non-infériorité : On cherche à montrer que la molécule testée n’est pas inférieure au traitement de référence. La limite de ce type d’essai est qu’il faut inclure un très grand nombre de malades (au moins 3000) pour pouvoir conclure, ce qui pose problème dans les maladies rares. Actuellement, il devient de plus en plus difficile de faire des essais contre placebo chez des malades qui ne reçoivent aucun traitement. Au plan éthique il est en effet difficile de laisser un malade sans traitement pendant plusieurs mois sachant que plusieurs médicaments efficaces sont déjà sur le marché. A l’heure actuelle, la plupart des essais dans l’HTAP sont réalisés chez des malades qui reçoivent un traitement préalable et on compare l’ajout d’un nouveau médicament par rapport à l’ajout d’un placebo. 3. Le financement (le nerf de la guerre…) Le plus souvent privé (industriel) • Essais de phase I, II, III, IV pour les médicaments, • Essais en vue de l’enregistrement des médicaments (essais contrôlés, phase III) • Parfois études épidémiologiques (Trop) rarement institutionnel • Très rare pour les médicaments • Etudes épidémiologiques ; évaluation des pratiques ; études à partir des registres… • PHRC (projet hospitalier de recherche clinique), contrats de recherche clinique… II - Structure d’un essai clinique Un essai clinique repose sur un partenariat entre l’industrie et des médecins (qui font partie d’un comité scientifique). Dans tout essai clinique, le projet est présenté à un comité d’éthique (le comité de protection des personne) qui autorise ou non l’étude. Chaque participant à l’étude doit signer un formulaire de consentement éclairé. En aucun cas ce consentement ne décharge les médecins de leur responsabilité médicale. L’essai clinique doit comporter : • Un objectif (exemple : amélioration du test de marche de 6 minutes) • Des critères d’inclusion et d’exclusion (par exemple, les mineurs sont exclus de la majorité des études) • Un critère principal de jugement (par exemple, distance parcourue au test de marche de 6 minutes) • Des critères de jugement secondaires (par exemple, le nombre d’hospitalisations, la variation d’une valeur biologique…) • Le recueil exhaustif des effets indésirables • L’analyse statistique des résultats III - Etudes contrôlées dans l’HTAP : pourquoi a-t-on fait évoluer les critères de jugement ? Avant la conférence de Dana Point en 2008, la variation de la distance parcourue au test de marche de 6 minutes était le critère de jugement principal des essais cliniques dans l’HTAP. Cependant il s’agissait d’études à court terme (3 à 6 mois) et ne concernant que relativement peu de patients (200 à 400). De plus, il a été montré que la variation de la distance parcourue au test de marche n’était pas prédictive de l’évolution de la maladie. C’est la raison pour laquelle il a été décidé lors du congrès mondial de Dana Point d’utiliser dorénavant un critère d’évolution clinique composite incluant la mortalité (morbi-mortalité) pour juger de l’efficacité des médicaments dans l’HTAP. Ces essais ayant la morbi-mortalité comme critère principal de jugement doivent être envisagés sur une plus longue durée, et doivent inclure davantage de patients. Dans ce type d’essai, il est très important que les événements rapportés soient validés en « aveugle » par un comité indépendant. La 1ère étude qui a suivi ces recommandations est l’étude internationale SERAPHIN qui comparait le macitentan, un nouvel antagoniste des récepteurs de l’endothéline (comme le bosentan ou l’ambrisentan) à un placebo chez des malades naïfs de traitement ou bien recevant au préalable du sildenafil (en France, seuls les malades prétraités par sildenafil pouvaient être inclus). Cet essai a permis d’inclure 742 patients suivis pendant en moyenne près de deux ans. Le critère principal de jugement de cet essai était la survenue du premier événement de morbi-mortalité comme défini sur la Figure 1. Cette étude a montré une diminution significative du risque de survenue d’un événement de morbi-mortalité dans les groupes macitentan 3mg/j et 10mg/j par comparaison au groupe placebo (Figure 2). En d’autres termes, cela veut dire qu’il y a eu moins d’aggravation de l’HTAP dans les 2 groupes de patients traités par macitentan. Figure 1 : Critère principal de jugement de l’essai SERAPHIN 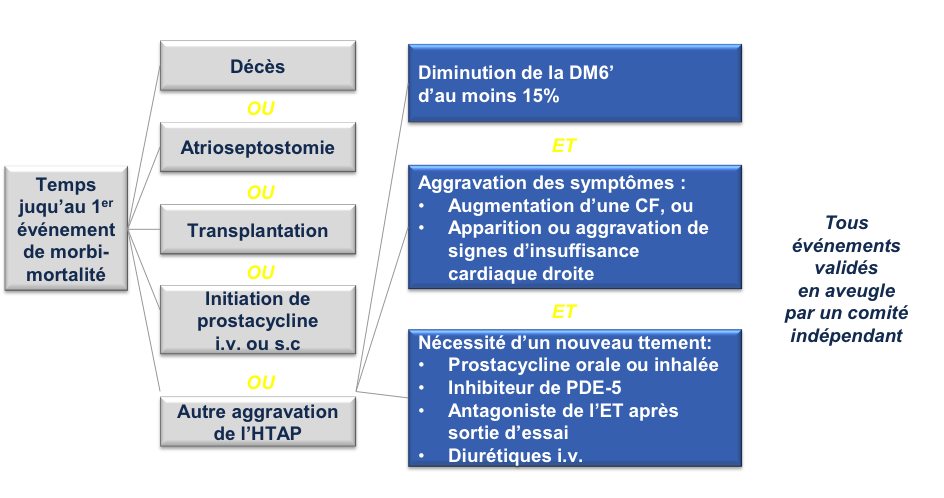 Figure 2 : Résultats du critère de jugement principal de l’essai SERAPHIN 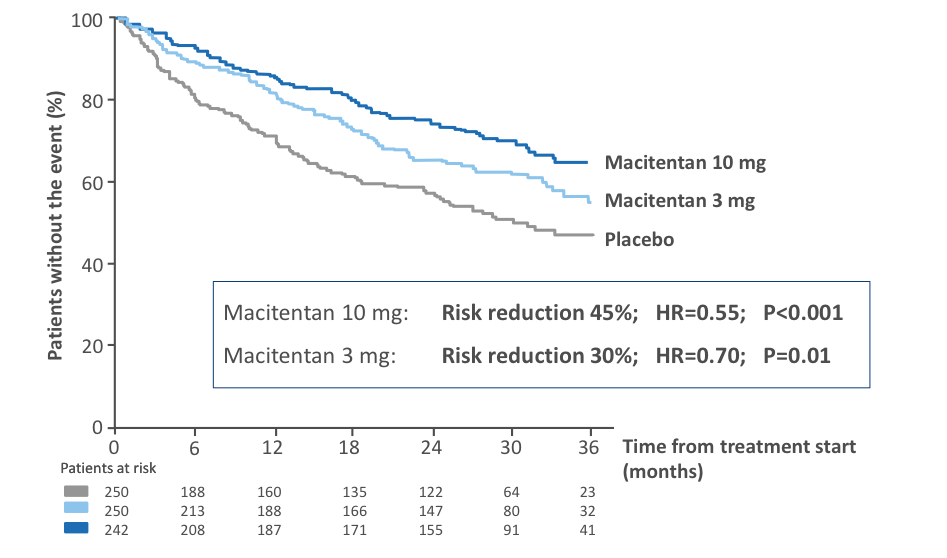 IV - Conclusions Les études actuelles et à venir dans l’HTAP visent à évaluer l’efficacité à long terme des médicaments sur la progression de la maladie (morbi-mortalité) et non plus uniquement les capacités à l’exercice (test de marche de 6 mn). La recherche clinique est indispensable pour approfondir les connaissances sur l’HTAP et développer de nouveaux traitements. Elle nécessite la collaboration de tous les acteurs : médecins, malades, personnel soignant, techniciens de recherche, industrie… Les essais apportent un bénéfice d’abord pour les malades. Grâce à la recherche, il y a maintenant 9 médicaments disponibles pour traiter l’HTAP. Il faut sortir de la croyance encore trop répandue : « Je participe un essai = Je suis un ‘cobaye’ »… « Il m’arrive de ne pas être en forme le jour du test de marche. Comment considérer le résultat compte tenu de ces variations d’énergie ? » On sort là de la recherche clinique, mais en pratique courante, on n’utilise pas uniquement le test de marche pour évaluer l’efficacité des traitements. Il y a aussi l’interrogatoire sur la vie quotidienne, les épreuves d’exercice (sur le vélo), les mesures biologiques, les paramètres mesurés à l’échographie cardiaque et surtout au cathétérisme cardiaque droit. « Les nouvelles molécules doivent-elles aussi être testées chez les enfants maintenant ? » Les essais sont différents chez les enfants et les adultes mais le principe général reste le même. Les molécules en test chez les adultes font partie du PIP (Plan d’Investigation Pédiatrique) dans un second temps pour les enfants. « Quelles sont les grandes études de phase III actuellement ? » - L’Etude SERAPHIN (macitentan, antagoniste des récepteurs de l’endothéline, par voie orale) dont on a parlé ci-dessus. Le médicament a eu une AMM au niveau européen et il sera mis sur le marché avant de la fin de l’année 2014. Son nom commercial sera OPSUMIT®. - L’étude GRIPHON (selexipag, agoniste des récepteurs de la prostacycline, par voie orale) dont la méthodologie est similaire à celle de l’étude SERAPHIN. L’étude est positive. - L’étude AMBITION qui étudie la combinaison d’emblée de 2 médicaments par voie orale (ambrisentan et tadalafil) vs un seul de ces traitements (ambrisentan ou tadalafil). - Il y a également quelques essais de phase IIIb avec le riociguat qui a été récemment approuvé (nom commercial ADEMPAS®) dans l’hypertension pulmonaire post-embolique non accessible à un traitement chirurgical et d’une façon plus restreinte dans l’HTAP, en combinaison avec un antagoniste des récepteurs de l’endothéline, en l’absence d’autre possibilité thérapeutique. - Enfin, il faut signaler que le riociguat est un médicament qui ne peut pas être associé à un médicament de la famille du sildenafil (REVATIO®) et du tadalafil (ADCIRCA®), il s’agit d’ailleurs d’une contre-indication. Une étude est en cours pour montrer comment on pourrait envisager le switch du sildénafil vers le riociguat pour des patients qui sont insuffisamment améliorés. Dernière mise à jour: 12 février 2015 |
|
Agrément national par arrêté du 26 octobre 2007 pour la représentation des usagers du système de santé dans les instances hospitalières ou de santé publique




.png)


.jpg)
.jpg)


